XXXIV. Cnidários na Antártida
XXXIV. Cnidários na Antártida
Quem são os cnidários?
Os cnidários são animais que possuem cnidas, que são células urticantes que provocam queimaduras, inclusive em seres humanos. Essas células existem em todos os componentes desse grupo, cuja origem está na base da filogenia dos Metazoa, ou seja, da árvore filogenética (Fig. 1). Dentre os membros do filo Cnidaria, os mais conhecidos são os corais, as anêmonas, as caravelas e as águas- vivas.
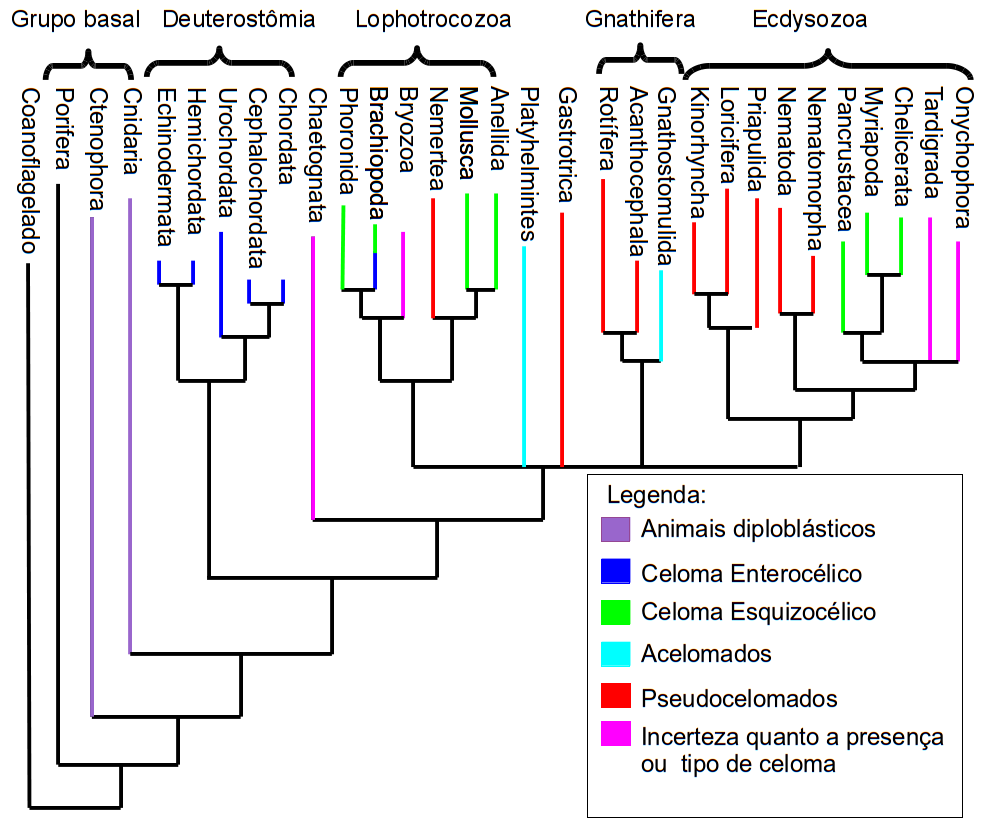
Figura 1:Árvore filogenética dos Metazoa (todos os animais). Podemos observar que a origem dos cnidários está na base da filogenia, juntamente com os Ctenophora e os Porifera. Fonte: https://pt.wikipedia.org/wiki/Ficheiro
Morfologia e ciclo de vida
A morfologia dos cnidários é bem simples, eles possuem apenas duas camadas de células, a epiderme, que é a camada mais externa e a gastroderme, que é a camada mais interna, tendo entre elas, a mesogléia, que é uma camada extracelular (que fica fora das células) gelatinosa, e tem como principal função ser um tecido de revestimento. Existem duas formas de vidas dos cnidários: as bentônicas, em forma de pólipos, que normalmente ficam presos ao solo, e as planctônicas, em forma de medusas (águas-vivas), que ficam na coluna d’água (Fig. 2). Mesmo com certo poder de natação por meio de contrações musculares, as águas-vivas são consideradas planctônicas, por serem levadas pelas correntes marítimas.
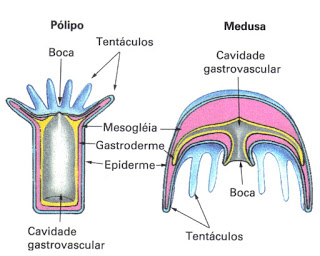
Figura 2: À esquerda está representado um pólipo de um cnidário, a forma bentônica desses animais; à direita, uma medusa (ou água-viva), que vive na coluna d’água. Podemos observar que a estrutura do corpo dessas duas formas é semelhante. Fonte: http://atricolinabiologa.blogspot.com/2019/04/celenterados-ou-cnidarios.html
O ciclo de vida dos cnidários é considerado um ciclo de vida metagenético, ou seja, podemos encontrar as duas formas de vida, tanto de medusa como de pólipo. O grupo Anthozoa, grupo das anêmonas e corais, é conhecido por não ter a forma de medusa, e o grupo dos Medusozoa, conhecido por ter a forma de medusa em seu ciclo de vida.
Existem diferentes tipos de reprodução de um cnidário, tanto assexuada como sexuada. No primeiro caso, podemos citar diferentes maneiras de reprodução que resultam em pólipos, como é o caso de podocistos, brotamentos laterais e fissões longitudinais, que são formas diferentes de um pólipo dar origem a outro. Já no caso da estrobilização, temos um pólipo dando origem a uma éfira, ou medusa juvenil. Nela, o pólipo realiza divisões transversais e ocorrem mudanças na conformação de seus tecidos, fazendo com que no final do processo seja lançada no ambiente uma medusa. Por fim, temos a reprodução sexuada, que é realizada pela junção de gametas femininos e masculinos que são lançados na água, seja por medusas ou por anêmonas e corais. O gameta feminino é então fecundado pelo masculino, que pode gerar tanto uma plânula (estágio larval) que se desenvolverá posteriormente em um pólipo, como outra medusa, fechando assim o ciclo de vida (Fig. 3).
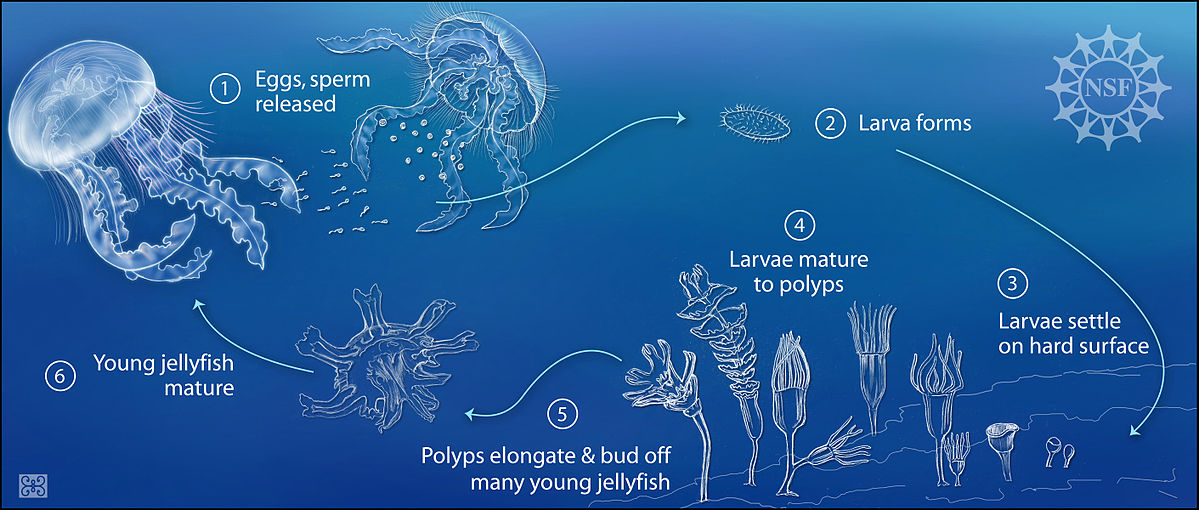
Figura 3: Esquema do ciclo de vida de um cnidário. 1: ovos e esperma liberados na água; 2: formas larvais (plânulas); 3: fixação das larvas em superfícies duras; 4: larvas maturam em forma de pólipos; 5: pólipos realizam reproduções assexuadas, como a estrobilização, para formar as medusas (águas-vivas); 6: medusas jovens (éfiras) crescem e viram medusas adultas.
Fonte: https://commons.wikimedia.org/wiki/File:Reproductive_cycle_of_jellyfish.jpg
Vale ressaltar que ainda há muito a se descobrir sobre os cnidários e seus ciclos de vida tão variados, além das curiosidades e fatos que apresentamos a seguir!
Os desafios do ambiente antártico
Os ambientes polares têm temperaturas baixas durante todo ano e, devido à sua posição, eles passam por variações sazonais como as de intensidade de luz e de congelamento da superfície do mar, tornando esses locais extremos em condições ambientais.
Na Antártida, a ação das ondas e do gelo afeta a distribuição dos organismos e sua estabilidade, principalmente em locais de águas rasas onde o substrato pode ser escavado pelos icebergs, que ao se arrastarem no fundo perturbam as comunidades que vivem nessas regiões. O gelo âncora, que se forma junto ao solo marinho, é também outro fator de distúrbio em águas rasas, congelando os organismos que estavam no local de sua formação e transportando-os para a superfície ao se desprenderem do fundo. Para ver um exemplo dos efeitos da escavação o vídeo “See How Ice Can Scar The Ocean Floor Enough To Be Seen From Space” (disponível em https://www.youtube.com/watch?v=9_WMl5MLv-A) mostra o resultado da glaciação no fundo marinho, e um exemplo de gelo âncora pode ser visto em “Brinicle, Underwater Icicle "Finger of Death" (disponível em https://www.youtube.com/watch?v=lAupJzH31tc&t=5s)
Para sobreviver a estes distúrbios, uma das adaptações dos animais é a formação de colônias. Seu tamanho e forma permitem o uso máximo de espaço livre, alta flexibilidade e sucesso de reprodução, além de sobreviver a perturbações e crescer como nova colônia a partir de fragmentos da colônia mãe. Quando uma colônia é atingida por um iceberg, por exemplo, pode se dispersar através dos fragmentos gerados e carregados pelo gelo. Como na água há grande quantidade de alimentos na forma de detritos e material particulado, a maioria destes organismos é suspensívora, ou seja, se alimentam do que se deposita em seu aparelho bucal.
Em ambos os polos há a presença de cnidários e sua abundância está relacionada com a extensão do gelo, pois há variação sazonal de alimentos conforme os processos naturais de formação de gelo e o subsequente degelo (Arrigo, 2014).
Cnidários da Antártida e sua distribuição
Nas regiões antárticas foram registradas mais de 9.700 espécies de cnidários, sendo a maioria bentônica. Contudo, há uma quantidade bem maior de estudos sobre os organismos pelágicos (que vivem livres na água). Dentre eles, podemos citar a cifomedusa Poralia sp. que vive em profundidades menores do que 600 m e geralmente é encontrada em regiões com baixas temperaturas, alta salinidade e baixa concentração de oxigênio.

Figura 4: Cifomedusa Poralia sp.
Fonte: http://www.marinespecies.org/aphia.php?p=image&tid=135310&pic=80782
Os hidrozoários constituem um dos grupos mais característicos do bentos Antártico, porém sabe-se muito pouco sobre esse grupo em algumas regiões. Como exemplo de estudo, podemos citar a região da “George V Coast”. Para contribuir com o aumento de informações sobre a área, um estudo foi realizado na “George V Coast” (leste da Antártida) em 2007, onde foram identificadas 12 espécies de hidróides, das quais 7 foram registradas pela primeira vez. Todas as espécies eram endêmicas da região antártica ou sub-antártica e uma espécie, Staurotheca antarctica, apresenta substâncias que evita a sua predação por determinados crustáceos e também contém nematocistos, que protegem o organismo da predação por estrelas-do-mar.
 |
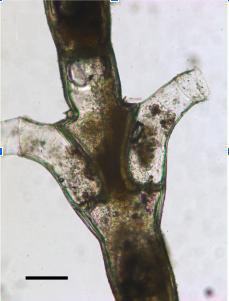 |
Figura 5: À esquerda mapa de localização da George V Coast e à direita hidrozoário Staurotheca Antartica. Fonte: Cantero & Marzal (2018).
Relações ecológicas
Os cnidários possuem muitas relações com outros organismos, e um exemplo curioso é com o ouriço Sterechinus neumayeri, que é um predador na Antártida. Quando este ouriço se movimenta próximo à anêmona Isotealia antarctica (Fig. 6), esta tenta capturá-lo como alimento. O que torna esta relação especial é que o ouriço para escapar da anêmona criou uma relação benéfica com macroalgas vermelhas das espécies Pyllophora antarctica e Iridaea cordata (Fig. 6). O ouriço usa as macroalgas fixadas em seus espinhos, e quando a anêmona tenta capturá-lo, acaba pegando as macroalgas, permitindo que o ouriço consiga fugir. Para as algas essa relação é benéfica porque quando o ouriço se movimenta pelos fundos oceânicos, permite que ela se reproduza em diferentes lugares, valendo a pena o risco de ser capturada pela anêmona.
 |
 |
Figura 6: À esquerda o ouriço coberto com a macroalga como um escudo, e à direita, a anêmona que tenta capturá-lo.
(Fonte: http://www.oikonos.org/apfieldguide/album/Echinodermata/Echinoidea%20-%20sea%20urchins/ e
https://www.sealifebase.ca/summary/Isotealia-antarctica.html)
Outra relação interessante acontece com o peixe bentônico Trematomus bernacchii (Fig. 7) que é comum na região de “McMurdo Sound” e tem uma preferência alimentar clara: ele adora a anêmona escavadora com tentáculos visíveis Edwardsia (Fig. 7). Esta anêmona é sedentária (permanece muito tempo em um local, mas não está completamente fixa) e só mexe seus tentáculos para capturar seus próprios alimentos e com este movimento atrai o peixe que sente a vibração por meio de sua linha lateral. Sabe-se que o peixe tem essa preferência porque mesmo com variedade de alimentos ou pouca luz no inverno, ele ainda assim escolhe a Edwardsia para se alimentar.
 |
 |
Figura 7. À esquerda a anêmona Edwarsia e à direita o peixe Trematomus bernacchii (Fontes: http://portugal.inaturalist.org/taxa/88101-Edwardsia; http://www.fishbiosystem.ru/PERCIFORMES/Nototheniidae/Trematomus_bernacchii2.html)
Um curioso caso de predação entre cnidários pode ser observado em octocorais na Antártida. Um exemplo destes organismos é a Primnoella scotiadae que tem seu crescimento afetado pela ação de ondas que quebram os ramos do octocoral e também pela predação. O que torna esse exemplo tão diferente é que a P. scotiadae é predada por uma anêmona, a Dactylanthus antarcticus. Este processo de predação pode ser visto na Figura 8: a letra A mostra quando a anêmona se fixa no octocoral e começa a predá-lo; a letra B mostra como o octocoral fica depois que a anêmona o consome por completo, permanecendo apenas o exoesqueleto. Quando ela acaba uma colônia, a anêmona se infla (D) e busca outra colônia (C) para consumir.

Figura 8: . Exemplo da predação de octocorais por anêmona. (PECK & BROCKINGTON, 2013)
Os corais têm relações ecológicas com microrganismos, sendo sua superfície corporal habitada pelos mesmos. As comunidades de microrganismos podem variar de acordo com diversos fatores e, dentre eles, podemos citar a contaminação do ambiente. Por isso, um estudo realizado em 2007 comparou as comunidades de microrganismos que habitam a superfície de uma espécie de coral mole (Alcyonium antarcticum) em três diferentes locais com diferentes níveis de contaminação. Os resultados indicaram que houve uma maior diversidade de microrganismos nos locais associados a uma maior contaminação. Além disso, foram encontradas bactérias redutoras de sulfato que tinham sido associadas anteriormente apenas a corais doentes, o que indica que há micronichos dentro dos tecidos dos corais que não necessitam de oxigênio.
Os cnidários também podem alterar a população de outros organismos devido à predação e podem ter adaptações para conseguirem sobreviver em períodos onde há diminuição da quantidade de alimento. Algumas espécies de gorgônias apresentam adaptação para sobreviver à redução de alimento causado pela diminuição da produtividade primária no outono. Uma grande parte da alimentação desses organismos está relacionada à ressuspensão de material ou de sedimentos. Sendo assim, há uma hipótese de que eles conseguem lidar bem com o inverno, mesmo com a escassez de alimentos, devido ao consumo de “tapetes de microalgas” que são formados por microalgas que sedimentaram.
A dieta dos octocorais Primnoisis antarctica e Primnoella sp. é composta majoritariamente por organismos que pertencem às comunidades de plâncton de pequeno tamanho. Apesar disso, os organismos maiores do zooplâncton também são importantes na sua dieta devido à grande quantidade de carbono neles armazenada, fazendo com que contribua para suprir as necessidades de energia necessária. Os octocorais possuem um baixo metabolismo, o que juntamente com a ingestão de presas com alto valor nutritivo, contribui para que eles possam passar por períodos onde há uma menor quantidade de alimento disponível. Além disso, as espécies possuem capacidade de se alimentar de material em suspensão em baixas concentrações e ingerem microalgas bentônicas, o que também pode auxilia-los a continuarem ativos em períodos de maior escassez.
Os hidróides Hydractinia angusta vivem na superfície de conchas de moluscos. Podem se alimentar de duas formas: na primeira eles se desprendem da superfície do molusco para se alimentar de partes de ouriços e na segunda eles se alimentam de aglomerações de microalgas bentônicas. A ingestão de partes de ouriços pelos hidróides pode ser benéfica para o molusco, pois pode reduzir ou impedir que ocorra a raspagem das conchas dos moluscos para a ingestão dos filmes de algas pelo ouriço (Fig. 9). A H. angusta foi a primeira espécie de hidróide identificada que ingere apenas porções das presas e que ingere alimentos muito maiores do que seu tamanho corporal.
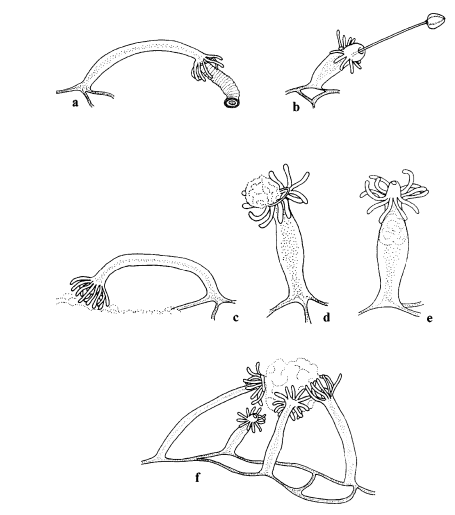
Figura 9: Representação da alimentação de Hydractinia angusta por partes de ouriços (a, b) e por microalgas (c, d, e, f). Fonte: Cerrano et al., 2000.
Para Saber mais
Amsler, C. D., Mcclintock, J. B., Baker, B. J. (1999). An Antarctic feeding triangle: defensive interactions between macroalgae, sea urchins, and sea anemones. Marine Ecology Progress Series, v. 183, p. 105-114.
Arrigo, K. R. (2014). Sea ice ecosystems. Annual Review of Marine Science, v. 6, p. 439-467, 2014.
Adler, L., Jarms, G. (2009). New insights into reproductive traits of scyphozoans: Special methods of propagation in Sanderia Malayensis GOETTE, 1886 (Pelagiidae, Semaeostomeae) enable establishing a new classification of asexual reproduction in the class Scyphozoa. Marine Biology, 156, 1411-1420.
Cantero, Á. L. P., Marzal, M. F. (2018). Benthic hydroids (Cnidaria: Hydrozoa) from off George V Coast (East Antarctica). Zootaxa, 4441(1), 121.
Cerrano, C., Cerrano, C., Puce, S., Chiantore, M., Bavestrello, G.(2000). Unusual trophic strategies of Hydractinia angusta (Cnidaria, Hydrozoa) from Terra Nova Bay, Antarctica. Polar Biol 23, 488–494.
Elias-Piera, F., Rossi, S., Gili, J. M., Orejas, C. (2013). Trophic ecology of seven Antarctic gorgonian species. Marine Ecology Progress Series, 477, 93-106.
Gutt, J., Schickan, T. (1998) Epibiotic relationships in the Antarctic benthos. Antarctic Science, v. 10, n. 4, p. 398-405.
Kiest, K. A. (1993). A relationship of diet to prey abundance and the foraging behavior of Trematomus bernacchii. Polar Biology, v. 13, n. 5, p. 291-296, 1993.
Levinton, Jeffrey S. (2001) Marine biology: function, biodiversity, ecology. New York: Oxford University Press.
Nelson, M. M., Phlegerr, C. F., Mooney, B. D., Nichols; P. D. (2000). Lipids of gelatinous Antarctic zooplankton: Cnidaria and Ctenophora. Lipids, v. 35, n. 5, p. 551-559.
Orejas, C., Gili, J., López-González, P., Arntz, W. (2001). Feeding strategies and diet composition of four Antarctic cnidarian species. Polar Biology, 24(8), 620–627. doi:10.1007/s003000100272
Orejas, C., Gili, J. M., & Arntz, W. (2003) The role of the small planktonic communities in the diet of two Antarctic octocorals (Primnoisis antarctica and Primnoella sp.). Marine Ecology Progress Series, 250, 105-116.
Peck, L. S., Brockington, S. (2013). Growth of the Antarctic octocoral Primnoella scotiae and predation by the anemone Dactylanthus antarcticus. Deep Sea Research Part II: Topical Studies in Oceanography, v. 92, p. 73-78.
Peck, L. S., Convey, P., Barnes, D. K. (2006). Environmental constraints on life histories in Antarctic ecosystems: tempos, timings and predictability. Biological reviews, v. 81, n. 1, p. 75-109.
WEBSTER, N. S., BOURNE, D. (2007) Bacterial community structure associated with the Antarctic soft coral, Alcyonium antarcticum. FEMS Microbiology Ecology, v. 59, n. 1, p. 81-94.
Autoras:
Anabelle Klovrza
Bruna Oliveira
Keisy Aline Rodrigues.
Coordenadores: Vicente Gomes e Amanda Gonçalves Bendia - IOUSP.


